2019年诺贝尔生理学或医学奖深度解读!
北京时间10月7日下午17:30,2019年诺贝尔生理学或医学奖揭晓,来自霍华德-休斯医学研究所的William G. Kaelin Jr、弗朗西斯-克里克研究所的Sir Peter J. Ratcliffe和约翰斯霍普金斯的Gregg L. Semenza因揭示细胞感知和适应氧气供应的机制而获得此奖。
动物需要氧气来将食物转化成为可用的能量,几个世纪以来,科学家们已经非常了解氧气的重要性了,但细胞如何适应氧气水平的改变,研究人员一直并不清楚。研究者William G. Kaelin Jr., Sir Peter J. Ratcliffe和Gregg L. Semenza通过研究揭示了细胞如何感知并适应氧气供应的变化,他们鉴别出了一种特殊的分子机制,其能调节基因的活性来响应不同水平的氧气。
今年诺贝尔生理学或医学奖得主的重大研究发现揭示了生命中最重要的适应性过程之一其中的机制,其能为我们理解氧气水平影响细胞代谢和生理学功能奠定一定的基础,相关研究发现或有望帮助开发治疗贫血、癌症和多种人类疾病的新型策略。
氧气处于中央舞台
氧气的分子式是O2,其占地球大气的五分之一,同时氧气还是动物生命所必须的成分,其能被存在于几乎所有动物细胞中的线粒体所利用,以便能将食物转化为有用的能量,1931年诺贝尔生理学或医学奖得主Otto Warburg就揭示了食物转化为能量的过程是一个酶催化的过程。
在进化过程中,机体会产生一种特殊机制来确保组织和细胞能得到足够的氧气供应,颈动脉体与颈两侧的大血管相邻,其含有特殊的细胞,能够感知血液中氧气的水平。1938年,诺贝尔生理学或医学奖授予Corneille Heymans,以表彰其揭示通过颈动脉体的血氧感应是如何通过与大脑的直接交流来控制机体呼吸频率的。
HIF进入到了场景中
除了颈动脉体快速适应低氧水平(缺氧)外,机体中还存在其它基本达到生理学适应过程,缺氧的一个关键生理学反应就是促红细胞生成素(EPO)水平的上升,其能够增加机体红细胞的产生,激素控制的红细胞产生的重要性早在20世纪初期就广泛人们所知,但这一过程本身是如何被氧气所控制的,目前仍然是一个谜题。
研究者Gregg Semenza就对EPO基因进行了研究,同时揭示了其是如何被不断改变的氧气水平所调节的,通过使用基因修饰小鼠进行研究,研究者发现,位于EPO基因附近的特殊DNA片段能够介导机体对缺氧的反应;研究者Sir Peter Ratcliffe则对EPO基因的氧气依赖性调节进行了研究,研究人员发现,几乎所有组织中都存在氧气感应机制,并不仅仅是在正常产生EPO的肾脏细胞中,这些研究发现也指出,这种机制是非常普遍的,而且其在很多不同类型的细胞中都能发挥作用。
研究者Semenza希望能够鉴别出介导这种反应的细胞组分,当其对培养中的肝脏细胞进行研究时,他发现了一种特殊蛋白复合体,其能以一种氧气依赖性的方式与所鉴别出的DNA片段相结合,研究者将这种复合体称之为缺氧诱导因子(HIF,hypoxia-inducible factor),1995年Semenza开始了对HIF复合体的广泛研究,同时其研究团队也发表了一些重要的研究成果,包括鉴别出了编码HIF的基因等,HIF由两种不同的DNA结合蛋白组成,即所谓的转录因子,如今叫做HIF-α和ARNT,如今研究人员可以开始解开这个难题了。
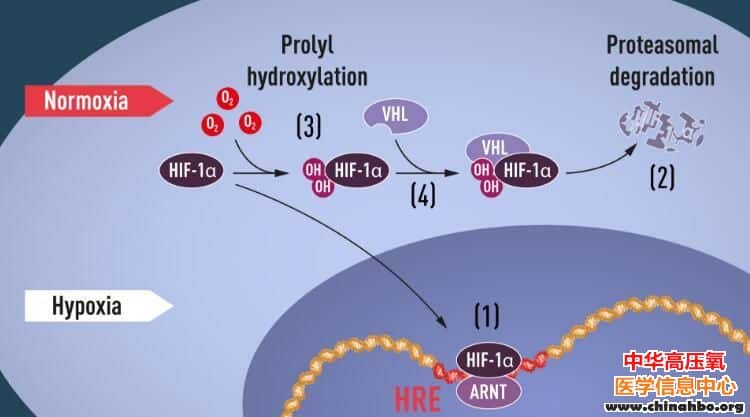
图1:当氧气水平较低时(缺氧),HIF-1α就能被保护免于在细胞核中被降解和积累,在细胞核中,其能与ARNT绑定并在缺氧调节基因中与特殊DNA片段相结合(1);在正常氧气水平下,HIF-1α能被蛋白酶体快速降解(2);氧气能通过将羟基基团添加到HIF-1α上来调节降解过程(3);VHL蛋白能够识别并形成一个携带HIF-1α的复合体,从而以一种氧气依赖性的方式来对其进行降解(4)。
VHL:一个意想不到的合作伙伴
当氧气水平较高时,细胞中就会拥有较低水平的HIF-α。然而,当氧气水平较低时,HIF-α的水平就会增加以便其能结合并调节EPO基因和其它携带HIF结合DNA片段的基因(图1);目前多个研究小组通过研究发现,正常情况下能够快速降解的HIF-α能够在缺氧时防止发生降解,在正常的氧气水平下,被称之为蛋白酶体(proteasome,2004年诺贝尔化学奖得主Aaron Ciechanover所发现)的细胞及其能够降解HIF-α,在这种情况下,一种名为泛素的小型肽类则会被添加到HIF-α上,泛素是蛋白酶体降解蛋白质的一个标记,泛素如何以一种氧气依赖性的方式与HIF-α进行结合目前仍然是科学家们研究的一个核心问题。
答案似乎来自于一个意想不到的方向,当研究者Semenza和Ratcliffe在研究EPO基因调控的同时,癌症研究者William Kaelin, Jr正在研究一种遗传性综合征—von Hippel-Lindau病(VHL病,希佩尔林道病),这种遗传性疾病会导致携带遗传性VHL突变的家庭成员患某些特定癌症的风险明显增加,研究者Kaelin表示,VHL基因能够编码一种抑制癌症发生的特殊蛋白质;此外,他还发现,缺少功能性VHL基因的癌细胞通常会表达异常高水平的低氧调节基因,但当VHL基因被重新引入癌细胞时,癌细胞又会恢复正常水平,这是一条重要的线索,其能够表明,VHL在某种程度上参与到了缺氧状态的调节过程中。来自多个研究小组的科学家们通过研究发现,VHL是泛素标记蛋白质复合体的一部分,其能够促进蛋白质被蛋白酶体所降解;研究者Ratcliffe及其团队通过研究发现,VHL能物理性地与HIF-α相互作用,同时其也是正常氧气水平下进行蛋白质降解所必须的,这就证实了VHL与HIF-α之间的神秘关联。
氧气改变了平衡
目前很多研究已经到位了,但研究者仍然缺乏的是理解氧气水平调节VHL与HIF-α之间相互作用的机制,研究者重点对HIF-α蛋白中对VHL依赖性降解的部分进行了重点研究,研究者Kaelin和Ratcliffe推测,氧气感知的关键或许存在于蛋白质结构域的某个位点。2001年同时发表的两篇研究报告中,研究人员发现,在正常氧气水平下,羟基基团会被添加到HIF-α的两个特定位点(图1),这种称之为prolyl羟基化(脯氨酰羟基化)的蛋白质修饰能够促进VHL识别并结合HIF-α,从而就能够解释正常氧气水平如何在氧气感知酶类(所谓的prolyl羟化酶)的帮助下控制HIF-α的快速降解。研究者Ratcliffe等人的进一步研究确定了关键的prolyl羟化酶,同时他们还揭示,HIF-α的基因激活功能能被氧气依赖性的羟基化所调节,如今研究者已经阐明了氧气感知的机制以及其是如何进行工作的。
图2:获得2019年诺贝尔生理学或医学奖的氧气感应机制研究在机体生理学研究上具有重要意义,比如其对于机体代谢、免疫反应和适应性运动能力等,同时许多病理学过程也会受到氧气感应的影响,目前研究人员正在加快速度研究来开发新型药物抑制或激活氧气调节机制,从而有效治疗贫血、癌症和其它疾病。
氧气能够塑造机体生理学和病理学改变
基于今年诺贝尔生理学或医学奖得主的开创性工作,如今我们能够深入理解不同氧气水平调节机体基础生理学过程的分子机制,氧气感应能够促进细胞适应低氧水平下的代谢,比如机体进行激烈运动时的肌肉状态。氧气感知所控制的适应性过程的其它例子还包括心血管的生成和红细胞的产生,机体免疫系统和许多其它生理学功能都会被氧气感知机器进行精细化地调节,氧气感知对控制正常血管的形成和胎盘的发育也至关重要。
氧气感知过程是多种疾病发生的核心(图2),比如,慢性肾脏功能衰竭的患者常常因为EPO表达水平的下降而遭受严重贫血,EPO能够被肾脏中的细胞所产生,其对于控制红细胞产生至关重要。此外,氧气调节机制在癌症发生过程中也扮演着非常关键的角色;在肿瘤中,氧气调节机器能被用来刺激血管生成和重塑细胞代谢,从而有效地促进癌细胞增殖,目前很多实验室和制药公司都正在不断深入研究,重点研究能够通过激活或阻断氧气感知机制来干预不同疾病状态的新型药物。
关键研究成果:
Semenza, G.L, Nejfelt, M.K., Chi, S.M. et al. Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, (1991)88, 5680-5684, doi: 10.1073/pnas.88.13.5680
Wang, G.L., Jiang, B.-H., Rue, E.A. et al.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA (1995), 92, 5510-5514,doi: 10.1073/pnas.92.12.5510
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., et al. The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature(1999), 399, 271-275 doi:10.1038/20459
Mircea, I., Kondo, K., Yang, H.,et al. HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science(2001), 292, 464-468,doi:10.1126/science.1059817
Jakkola, P., Mole, D.R., Tian, Y.-M., et al. Targeting of HIF-α to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science(2001), 292, 468-472, doi:10.1126/science.1059796
2019年诺贝尔生理学或医学奖得主简介:
William G. Kaelin, Jr.
1957年出生于纽约,取得了杜克大学的博士学位,William Kaelin, Jr在约翰霍普金斯大学和达纳-法伯癌症研究所接受了内科和肿瘤学的专科培训,同时在达纳-法伯癌症研究所建立了自己的实验室,并与2002年正式成为哈佛医学院的正教授,从1998年开始,其就成为了霍华德休斯顿医学院的研究员。
Sir Peter J. Ratcliffe
1954年出生于英国兰开夏郡,其在剑桥大学学习医学,并在牛津大学接受了肾病学的专业培训,同时在牛津大学建立了自己独立的研究小组,并于1996年成为正教授,目前Sir Peter J. Ratcliffe是Francis Crick研究所的临床研究主任,牛津Target发现研究所的主任以及路德维希癌症研究所的研究成员。
Gregg L. Semenza
1956年出生于纽约,其获得了哈佛大学的学士学位,并于1984年获得了宾夕法尼亚大学费城医学院的医学博士学位,同时在杜克大学接受了儿科专家的培训,并在约翰霍普金斯大学进行了博士后研究,建立了自己的研究团队,1999年Gregg L. Semenza成为了约翰霍普金斯大学的正教授,从2003年开始担任约翰霍普金细胞工程研究所血管研究计划小组的主任。
 此主题相关图片如下:1.jpg
此主题相关图片如下:1.jpg