一氧化碳功能多,能选择性的增加肿瘤细胞对化疗的敏感性1000倍!
内源性气体分子在人的正常生理功能中起不可缺少的作用
上个世纪末,一个毒性气体分子在医药领域掀起了一场革命。一氧化氮(NO)这样一个毒性气体被发现是一个人体不可缺少的重要的内源性信息传导分子。硝酸甘油治疗心脏病正是由于它可以提供NO,伟哥的作用也是因为它能增加男性生殖器官内NO的产生。因为NO这个伟大发现,1998年的诺贝尔医学奖授予了三位科学家:Robert F. Furchgott、Louis J. Ignarro和Ferid Murad,以奖励他们在发现这一气体传导分子中的先驱工作。2014-2015年,两个集中寻找基于NO医药的小型药物的公司(Ikaria和Cardioxyl)以数十亿美元被Mallinckrodt和BMS先后收购。继NO之后,另外两个气体分子也被发现是人体中必不可少的内源性信息传导分子:一氧化碳(CO)和硫化氢(H2S)。CO的重要性绝对与NO可以媲美。可以预计今后几年会有一股CO研究的高潮,医药产品也会随之出现。研究证明CO具有多种重要生理作用和潜在药理活性,如抗炎、抗菌、抗肿瘤以及显著提高器官移植中受体的存活率等。有报道CO能选择性的增加肿瘤细胞对化疗的敏感性(1000倍);此外,CO还能显著降低化疗药物的心脏毒性。这些发现都使得CO具有广阔的临床应用前景。但找到临床上易于使用的CO给药形式是一个重要难题。CO气体的输送有很多不可控的因素,如剂量控制、靶向输送、病人肺功能的个体差异性等,使得CO气体的临床转化异常困难。因此,CO作为药物开发面临的关键并不是药效问题,而是药物传递问题。最有效的策略就是开发一种安全可控的CO前药,以片剂形式给药(CO in a pill)。
临床开发CO,需要把这个气体做成片剂;但气体也可以做成片剂?
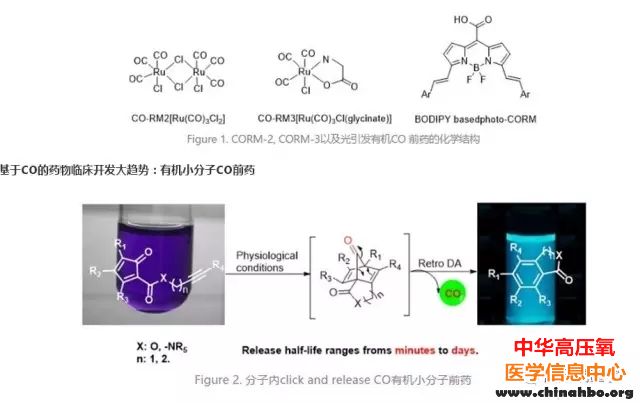
是的,气体做成片剂是可行的,但需要以前药的形式。药硝酸甘油作为NO供体已在此领域创下先例。但CO前药的设计是一项极具挑战性的工作。首先,CO作为气体小分子没有合适的基团可供化学衍生;其次,CO本身是一种非常惰性的气体,主要参与和过渡金属的配位形成金属络合物。迄今为止,大部分的CO供体(CO releasing molecules,简称CO-RMs)都是基于不同过渡金属的CO络合物,如CORM-2、CORM-3等(Figure 1)。显然,重金属的存在使得这类CORMs的临床应用存在很多阻力,理想的解决办法是应用有机小分子前药。虽然已有报道有机小分子CO前药(Figure 1),但这些前药不能在生理环境下释放CO,而是需要光引发。由于光缺乏组织穿透性,光敏前药不适合全身用药,因而无法广泛应用于临床。因此,开发具有临床应用前景且不需光引发的有机小分子CO前药是药物化学家面临的重大挑战。
乔治亚州立大学(Georgia State University)的王炳和课题组提出了开发具有临床应用前景且不需光引发的有机小分子CO前药的构思。这一构思也对今后开发基于CO的药物奠定基础。为了解决这一领域的关键技术难题,王炳和课题组与四川大学的柯博文课题组合作,首次提出了利用分子内的“Click Chemistry”实现小分子前药CO可控释放的设计,并成功制备和深入评价了该设计的一系列CO前药的相关理化性质与生物活性。设计这类小分子CO前药的一个难点在于怎样保证其能够在合成和分离纯化过程中具有足够的稳定性,同时又能保证在生理条件下快速释放CO。因此,课题组应用反应活性较低的炔来解决上述的矛盾。虽然炔和环戊二烯酮分子间的反应比较慢,但是如果把二者连在一个分子内,能够大幅度降低反应过程中的熵变,分子内的Diels-Alder(DA)反应就很可能在比较温和的条件下发生。除此之外,通过利用疏水作用可以进一步加快此类反应在生理环境下的反应速度,基于以上的思路,季兴跃博士设计并合成了一系列如上图所示的小分子化合物(Figure 2)。这些化合物在合成和存储过程中都表现出足够的稳定性,但一旦溶于DMSO/PBS溶液中,分子内的click反应迅速发生并快速释放CO。而且,click反应的副产物具有很强的蓝色荧光。因此,可以通过荧光强度变化的观察,可以实时监控这类CO前药在细胞内甚至是动物体内CO的释放。此外通过改变炔和环戊二烯酮之间的linker及linker上的取代基,可以很容易地控制CO的释放速度,半衰期从几分钟到几天。这一特性是其他任何已报道的CORMs所不具有的。在气体信使分子领域(CO, H2S, NO),释放速率与所呈现的生物表型密切相关,而不同疾病模型的干预对前药的释放速率也有不同的要求。因此,这一类小分子为研究CO释放速率和生物表型之间的关系提供了一类强大的化学工具。
有机小分子CO前药有很强的消炎作用,并在治疗结肠炎动物模型中有明显疗效
在随后的生物学评价中,这一类CO前药在小鼠巨噬细胞上表现出了很强的抗炎活性,化合物释放的CO能显著降低LPS诱导的TNF-α水平。为了进一步推动小分子CO前药向临床的转化,周诚博士深入研究了这类小分子在TNBS诱导的结肠炎小鼠模型上的抗炎活性。实验结果证明了这类小分子前药释放的CO对结肠炎小鼠模型具有显著的治疗作用。实验证明,前药释放的CO能明显提高结肠炎小鼠生存率,改善肠炎评分,干预结肠长度与厚度异常,并有效降低结肠过氧化物酶MPO与肿瘤坏死因子TNF-α水平。目前课题组正在进行新一代CO前药的开发工作,并积极探索该类小分子前药对其他疾病的治疗应用。目前,已有多家制药公司对该类前药表现出浓厚的兴趣。
 此主题相关图片如下:1.webp (11).jpg
此主题相关图片如下:1.webp (11).jpg