低氧是先天性心脏病脑损伤的关键因素
大部分复杂型先天性心脏病患儿在术前即存在大脑发育障碍、大脑成熟延迟甚至大脑损伤等神经结构和功能的异常。先天性心脏病是最普遍的生育缺陷,这种孩子不仅心脏有功能障碍,也容易出现行为、思维和学习等中枢神经系统功能异常。过去严重先天性心脏病患儿存活率比较低,先天性心脏病神经损伤的问题相对不突出。随着先天性心脏病治疗手段和治疗技术的提高,先天性心脏病患儿生存率明显提高,先天性心脏病中枢神经系统损伤问题才日益突出。神经系统损伤一旦造成,多不可逆,因此这一问题越来越受到新生儿科临床的重视。
过去对先天性心脏病导致的大脑损伤的细胞基础一直不是非常明确,最近来自美国华盛顿大学的一项研究发现,脑组织缺氧导致的神经干细胞数量和功能下降可能是先天性心脏病导致的大脑损伤的关键原因,这一发现给预防和治疗该疾病提供了重要思路。波士顿儿童医院儿童神经病学家 Caitlin Rollins 认为结果非常令人激动,对理解这种脑损伤发生的分子和细胞机制提供了思路,她说将来给孕妇使用药物或许可以阻断这一病变过程。
先天性心脏病由于心脏功能不足,造成氧气向大脑的运输效率下降,氧气无法满足胎儿大脑的基本需要就会造成大脑缺氧。脑缺氧是脑损伤的基本原因,以至于在三月胎龄胎儿就可以用 MRI 发现大脑异常,心脏异常可在三月胎龄胎儿用常规超声检查发现。但是一直到最近,科学家仍然不清楚胎儿大脑发育障碍的内在细胞学基础。
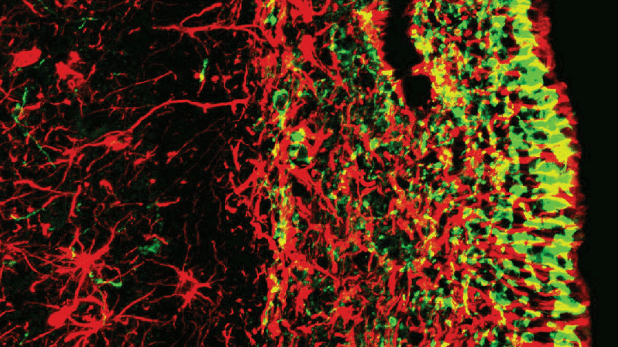
华盛顿国家儿童健康系统科学通过给新生猪连续低氧,结果发现动物大脑的病变和人类先天性心脏病后脑损伤病理类型一致。猪崽出生后 2 天,给动物注射荧光细胞标记物,这种标记物能对大脑室下区细胞进行标记。哺乳动物新生儿脑室下区是最大的神经干细胞聚集区,干细胞从这里想多个脑区迁移并分化成多种类型的神经组织细胞。
出生第 3 天,研究人员给动物呼吸氧气浓度 10.5% 的气体,这相对于空气中氧气浓度(21%)的一半。当动物呼吸低氧气体连续 11 天到出生后 14 天,处死并取出这些动物脑组织,对照组动物连续呼吸正常空气,其他操作一样。研究人员对出生后 0 -36 天内,4 名死于先天性心脏病的和 5 名死于其他原因的人类患儿尸体脑组织进行了对比研究。研究论文发表在《科学转化医学》杂志上。
在出生后 1 周,猪脑室下区神经干细胞生成的神经元会迁徙到额叶大脑皮层,人类该区域在前额后负责高级思维。这些细胞主要分化为中间神经元,中间神经元一般是抑制神经元,能抑制兴奋性神经元的电活动。兴奋和抑制平衡是做出判断、事实综合和解决问题等高级大脑功能正常实现的重要前提。
猪崽低氧处理后,大脑室下区神经干细胞受到严重损伤,前脑皮层神经元和中间神经元数量显著减少。低氧组动物脑体积和重量都明显小于对照组,大脑皮层表面皱褶也明显少于对照组。与其他原因死亡的患儿对比,死于先天性心脏病的人类患儿大脑也显示室下区神经干细胞数量减少,脑重量和大脑皮层灰质均明显减少。
出生后数周内人类新生儿大脑仍然处于发育过程,给治疗这种疾病提供了关键机会。本文作者之一,心外科专家 Richard Jonas 说,刚出生后神经元仍然可以继续再生,给先天性心脏病患儿大脑损伤的早期治疗提供了细胞学基础。虽然这一发现并不能立刻转化为临床应用,但是这一发现足够让儿科和心外科医生兴奋。多伦多儿科医院儿科神经病学家 Steven Miller 认为这个研究非常强大,这是走向临床应用的第一步,将来可以设法刺激室下区产生更多新生神经元,以补充先天性心脏病患儿神经元数量的不足。
研究也存在不足,这种猪模型不能反映人类心脏病患者的真实情况,并没有反映人类在子宫内的缺氧过程,最多只代表出生后的缺氧情况。加州大学旧金山分校神经科学家 Arnold Kriegstein 也认为,只有中间抑制性神经元减少不足以解释大脑体积和皮层皱褶减少。中间抑制性神经元可能只是故事的一部分,而不是整个故事。
 此主题相关图片如下:1.png
此主题相关图片如下:1.png